La variación de la Energía Química se asocia con la variación en la composición o estructura de la materia ya que en una reacción química comenzamos teniendo reactivos y terminamos teniendo otras sustancias que son los productos:
REACTIVOS → PRODUCTOS
Los “reactivos y los productos” pueden o no estar en equilibrio, pero se debe admitir que si pasamos a tener productos a través de una reacción química, hubo cambios en la estructura de las sustancias reactivas que permitieron la “aparición” de los mismos.
Se debe entonces pensar en la importancia de los enlaces, como factores fundamentales en los intercambios de energía ya sean a presión constante o a volumen constante.
Luego si en un sistema químicamente reactivo, se produce un proceso, por ejemplo a P = cte. se podrá tener cambios en los componentes químicos y también en los térmicos:
qP = ∆HT + ∆HQ
Otra forma de graficar los cambios
Manteniendo el criterio de que la reacción no cambia la temperatura del sistema (con lo que los ejemplos se hacen más sencillos), y como sabemos que se produce efectivamente un ∆HQ en una reacción exotérmica, puede visualizarse como:
∑Hproductos menor que ∑Hreactivos
Y
∆HQ = ∑Hproductos - ∑Hreactivos menor que cero.
Luego el qP menor que cero, es cedido al medio ambiente.
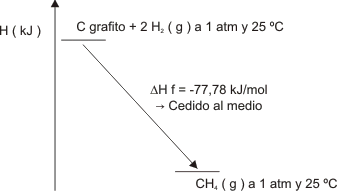
Gráfico número 15
e) En el ejemplo de una reacción endotérmica donde tampoco hay cambios en la temperatura del sistema, se visualiza como:
∑Hproductos mayor que ∑Hreactivos
Y
∆H o = ∑Hproductos - ∑Hreactivos mayor que cero.
Luego el qP mayor que cero, es cedido por el medio.
Gráfico número 16
Objeto de la termoquímica
El objeto de la termoquímica es el estudio de los cambios térmicos (energía que se gana o se pierde) en el curso de las reacciones químicas. Dicha energía que será siempre calórica a no ser que se acople a alguna máquina adecuada o proceso que la utilice, se podrá medir de dos maneras: a presión constante o a volumen constante.
A presión constante: ello significa que se está midiendo qP y usted recuerda que qP =∆H.
A volumen constante: ello significa que se está midiendo qV y usted recuerda que qV = ∆E.
de ahora en adelante no vamos a discernir entre
∆HT y ∆HQ
En general las medidas se realizan a presión constante por lo que los valores más utilizados son los de Entalpía:
REACTIVOS → PRODUCTOS ∆H tº= ?
El valor de ∆H tº ¿qué signo tendrá?: la respuesta es que existiendo reacciones endotérmica y exotérmica el “signo” será positivo o negativo de acuerdo a cada caso:
∆H = ENDOTÉRMICA → + positivo
∆H = EXOTÉRMICA → – negativo
Ampliemos un poco estos conceptos: Piense que ocurre cuando al cabo de una reacción química se produce calor que casi siempre (no en un sistema aislado, pero esto nunca ocurre) se dirige al entorno o medio ambiente
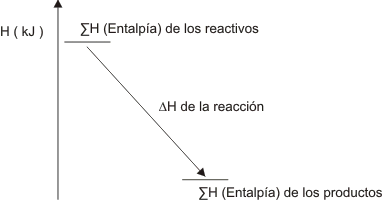
Gráfico número 17
Este sencillo gráfico nos indica que los productos de la reacción tienen menos energía que los reactivos, por eso la perdieron y por eso según la convención dicha energía es negativa.
¿Por qué encontramos “tº” como subíndice de ∆H ?: esto define la temperatura a la cual se realizó la reacción.
¿Por qué es importante aclarar este aspecto?: usted recuerda que H = E + PV luego debe admitir que por lo conocido respecto especialmente de E la temperatura juega un papel fundamental para establecer su valor. No es lo mismo por ejemplo, la energía de traslación de un gas (no necesariamente ideal) a 25ºC que a 90ºC, luego los valores logrados de H (entalpía) deben depender de la temperatura. Siendo esto así las diferencias o sea los ∆H como los graficados arriba pueden (y lo hacen) variar con la temperatura.
Conclusión: En toda reacción química debe especificarse la temperatura a la cual se realizó la misma.
Otro aspecto interesante es el estado de agregación (sólido, líquido o gas) de los reactivos y productos. Esto obviamente también interesa para el cálculo de los calores de reacción. Pregunta de rápida contestación: ¿qué diferencia hay en cuanto al contenido energético de una misma sustancia primero considerada como gas y luego cómo sólido?
Por supuesto la diferencia es muy grande, y ello es algo que U d. ya puede deducir por sí mismo recordando lo dicho al comienzo de este trabajo.
Luego el estado físico de los reactivos y productos deben especificarse cuando se escriben reacciones.
Un ejemplo:
2 S (s) + 3 O2 (g) → 2 SO3 (s) ∆H 298= -454,49 kJ/mol
2 S (s) + 3 O2 (g) → 2 SO3 (g) ∆H 298= - 395,72 kJ/mol
Insistimos: es fundamental anotar el estado físico de los reactivos y productos ya que de acuerdo al ejemplo dado no es lo mismo formar un mol de SO3 en estado gaseoso que el mismo compuesto pero en estado sólido. Sus ∆H difieren.
Resumiendo: qP = ∑H productos - ∑H reactivos = ∆H
∆H = con valor negativo es un calor que fluye al entorno.
∆H = con valor positivo es un calor que entra al sistema.
La entalpía de una sustancia cambia (al menos ligeramente) con la temperatura.
Ejemplo: H de 1g H2O (l) a 100ºC - H de 1g H2O (l) a 0ºC= 100 cal
Estos datos por supuesto se pueden obtener de tablas que usted puede encontrar en la bibliografía.
Tres últimos aspectos conceptuales sobre la entalpía.
Si recordamos que H = E + PV es obvio que la cantidad de entalpía de un sistema dependerá de su m asa (piense en las energías térmicas o en las intermoleculares en general). Por lo tanto es una: propiedad extensiva.
Ej. La entalpía de un mol de agua (18g) es 18 veces mayor que la entalpía de 1 g de agua.
Cuando una sustancia experimenta un cambio de fase se modifica su entalpía.
Ejemplo:
H de 1g H2O (l) a 0 ºC - H de 1g H2O (s) a 0ºC= 80 cal
H de 1g H2O (g) a 100ºC - H de 1g H2O (l) a 100ºC=540 cal